FDA 21 CFR 第 11 部分是什么?它为何对制药设备如此重要?
分享
简介:随着制药制造业日益数字化,监管机构越来越关注电子数据的完整性、完备性和可追溯性。美国食品药品监督管理局 (FDA) 的21 CFR 第 11 部分定义了电子记录和电子签名的规则。它已成为全球基准,也是制药设备进入美国和欧洲市场的“通行证”。本文将深入分析其核心要求,并解释为何设备制造商必须从一开始就将合规性纳入其系统设计中。
常见的合规误解
- 假设触摸屏或数据导出功能自动符合“数字合规”的条件。
- 忽略用户访问控制和审计跟踪的强制性要求。
- 缺乏生成系统日志、电子签名或恢复原始数据的能力。
- 在注册或客户审核期间尝试最后一刻的修复——通常代价高昂且造成破坏。
如何通过设备设计实现第 11 部分合规性
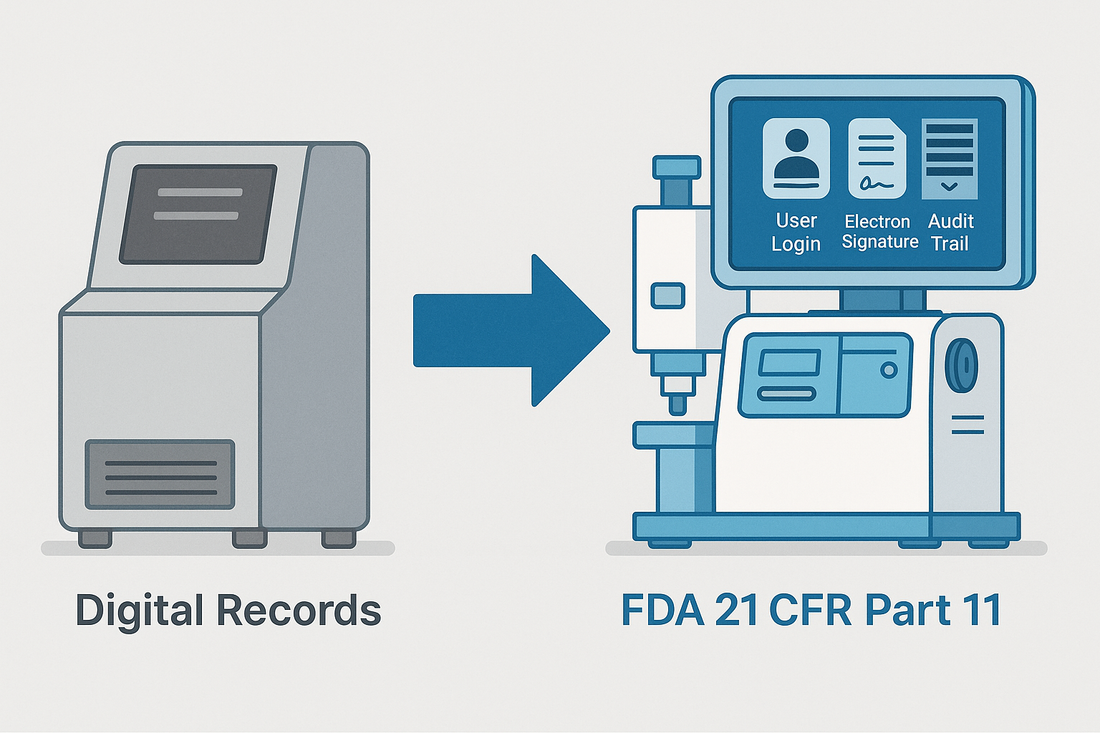
- 用户访问控制:系统必须支持分级权限和登录认证。
- 审计跟踪:每个操作都必须生成可追溯的日志,记录谁在何时做了什么。
- 电子签名:每条记录必须与经过验证的操作员身份和时间戳相链接。
- 数据完整性:记录的数据必须防篡改,并可安全导出和长期存档。
- 软件验证:系统必须支持 IQ/OQ 文档和验证测试。
黄海船舶遵守第 11 部分规定的方法
黄海在其涂层、激光钻孔和测试系统中集成了完整的第 11 部分支持模块:
- 基于Linux的控制软件:支持用户角色管理、自动审计日志、数据备份。
- 自动记录:所有参数变化都会自动记录操作员姓名和时间戳。
- 硬件灵活性:客户可以指定西门子或同等 PLC 以符合当地验证实践。
- 文档和培训:提供 IQ/OQ 验证文件和现场培训以支持审计和系统鉴定。
超越软件——合规性作为设计理念
第 11 部分合规性不仅仅是一个“软件功能”,更是对设计层面法规理解的体现。尽早嵌入合规性可以提高审核准备度和市场准入速度。黄海帮助客户将数据完整性直接融入设备生命周期,从配置到生产报告。
关键要点
FDA 21 CFR 第 11 部分确保电子记录和签名的可信、安全且可追溯。支持访问控制、审计追踪和验证数据处理的设备不仅满足监管要求,还能实现可靠、合规且面向未来的数字化制造。
要了解更多信息或索取我们的第 11 部分合规白皮书,请联系 HUANGHAI 技术团队。
